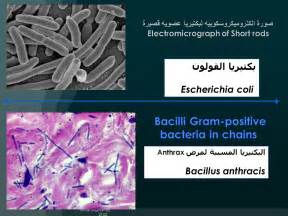
مراجعة كيمياء الفصل الاول
اكتب بما لا يتجاوز السطرين عن مايلي
طيف الانبعاث الذري – طيف الامتصاص الذري – مبدأ عدم التاكد لهايزنبرج – السحابة
الالكترونية – السالبية الكهربائية – الالفة الالكترونية – جهد التاين –
العزم الكهربائي – عسر الماء – الماء الملكي – الثلج الجاف – الالفة الالكترونية – الاحتباس
الحرري واسبابه واثاره على البيئة – الماء الاجاج – المولارية – المولالية – العالم الذي
وضع المعادلة الموجية – الطيف الذري – البرونز – مبدأ بولي للاستبعاد ، مبدأ هايزنبرج ،
انواع المحاليل مع التمثيل – الاس الهيدروجيني للماء – فلزات العملة – عدد الكم المغناطيسي
– عدد الكم الدوراني – الشكل الهندسي لجزئ الماء – انواع الحديد واستخداماتها – اهم
استخدمات الغازات النادرة – استخدام الفضة – المحلول الغروي – المحلول الحقيقي –
المحلول المعلق – التوتر السطحي – قانون هنري – استخدام النيون – استخدام صلب الكروم
– التناضح العكسي – الانتشار الغشائي – الحمض النووي DNA – المائ العذب ، الماء المالح
===========
اكتب ثلاث مركبات تساهمية واخري ايونية
===================
قارن بين كل من ذرة طمسن وذرة رذر فورد
ماهي سعة المجالات التالية s p d f
ما ذا تعرف عن البرونز ؟
==================
وضح بالرسم مايلي
تجربة رذر فورد – نموذج طمسن الذري – الرابطة التساهمية التناسقية لايون الامونيوم
وايون الهيدرونيوم
الرابطة الهيدروجينية بين جزيئات الماء
=============
احسب التركيز المولاري لمحلول تم تحضيره باذابة 20 جرام من هديدروكسيد الصوديوم
في كمية من الماء تكفي لتحظير نصف لتر
———–
كم جراما من كلوريد الصوديوم تلزم لتحضير محلول تركيزه 4 مولال في كمية من الماء
المقطر وزنها 1500 جرام
============
كم جراما من هيدروكسيد الصوديم يلزم لتحضير محلول تركيزه 6 مولارا في كمية من
الماء المقطر تكفي لتحضير 500 مللير من المحلول علما ان الاوزان الذرية هي Na
= 23 O = 16 H = 1
——————————–
اكتب التوزيع الإلكتروني لكل مما يلي الذهب – النحاس – الفضة
====================
وضح بالرسم
تجربة رذر فورد – تكون ايون الهيديرونيوم – تكون ايون الامونيوم – الرابطة الهيدروجينية